Lab on a chip : un écosystème tissulaire in vitro pour tester les médicaments contre la Covid-19
Une approche avant-gardiste à la croisée de la biologie, de la physique, de la chimie et de l’ingénierie

Lab on a chip : un laboratoire miniature pour mieux tester les traitements
Comprendre et réguler les systèmes naturels au niveau cellulaire est particulièrement intéressant pour la modélisation et le diagnostic des maladies, la médecine régénérative mais aussi les tests de l’efficacité des médicaments contre certains virus.
Dans le contexte de la pandémie de Covid-19, c’est sur ce dernier point que Yong Chen et son équipe concentrent actuellement leurs recherches. Pour cela, ils ont recréé in vitro un écosystème de cellules alvéolaires présentes dans les poumons, afin de mieux comprendre l’interaction entre le virus, les cellules attaquées et les cellules immunitaires du corps humain. Dès qu’il sera finalisé, ce dispositif expérimental servira de plateforme de dosage immunologique contre le Covid-19. Un projet minutieux, de long haleine, mêlant à la fois biologie, physique, chimie mais aussi ingénierie.
Pour Yong Chen, « il est naturel que les physiciens et les technologues proposent les nouvelles méthodes ou approches pour répondre aux questions ou appels en recherche biomédicale. ». Ce physicien de formation, passé par le laboratoire de photonique et de nanostructures (LPN) du CNRS, est spécialisé dans la microfluidique, un champ de recherche complexe mais qu’il qualifie avec simplicité de « plomberie miniature », une étude des fluides à échelle micro et nanoscopique.
Cette grande maîtrise de l’infiniment petit lui a permis de nombreuses collaborations dans son domaine d’abord, mais aussi et plus récemment sur le champ de la biologie. Depuis une dizaine d’années, il met son expertise au service de la santé.
Utilisés surtout en physique, les nouveaux champs d’application en biologie de la microfluidique se sont révélés particulièrement utiles pour traiter les échantillons cellulaires. Cette technique permet ainsi d’étudier le comportement des cellules de certains organes et les solutions métabolisées. Elle permet aussi de concevoir des unités d’analyse sur des plaquettes de la taille d’une puce électronique, appelées lab on a chip (comprendre littéralement « laboratoire sur une puce »).
Récréer in vitro un écosystème tissulaire humain
Dans le cas de ces recherches sur le Covid-19, Yong Chen et son équipe ont tout d’abord créé une membrane basale ultra-mince appelée patch. Celle-ci sert de support de culture cellulaire pour la réalisation écosystème in vitro dans une boîte de Pétri.
Ce patch est biomimétique et totalement organique, contrairement aux autres procédés qui utilisent des composants artificiels comme l’élastomère (une matière plastique). Les chercheurs ont ainsi élaboré cette membrane monocouche à partir de collagène de type IV et de laminine, qui sont les mêmes molécules que celles qui constituent une membrane basale in vivo. Une caractéristique primordiale car cette membrane-contact possède un rôle majeur dans la survie, la prolifération et la différenciation des cellules qu’elle va accueillir par la suite.
Parallèlement, à partir de cellules souches pluripotentes induites par l’homme (iPSCs) (1), l’équipe de recherche a développé une génération de cellules tissulaires respiratoires alvéolaires et capillaires endothéliales (2), ainsi que trois types de cellules du système immunitaire : les macrophages, les neutrophiles et les dendritiques.
Il est important que ces cellules tissulaires et immunitaires proviennent de la même souche, (l’équivalent du même organisme humain), pour qu’elles soient compatibles entre elles. La production automatisée de ces cellules, telle que l’a mise en œuvre l’équipe de Yong Chen, permet un gain de temps considérable en obtenant des cellules différenciées en seulement quelques semaines.
Les cellules respiratoires alvéolaires et capillaires sont ensuite mises ensemble en culture sur le patch organique, intégré dans un dispositif microfluidique avec une interface air-liquide, nécessaire à leur croissance.

Une fois le développement de ces cellules arrivé à un stage optimal, les protéines de pointe de coronavirus et les cellules immunitaire (les macrophages, les neutrophiles et les dendritiques) sont introduites au sein de l’écosystème, véritable laboratoire miniature. L'infection et la réaction immunologique du système ainsi que l'effet du médicament à tester sont étroitement surveillés par imagerie à immunofluorescence, ELISA et TEER, et grâce des anticorps et des réactifs biochimiques appropriés.

Une méthode rapide et économique, à la croisée des discipline
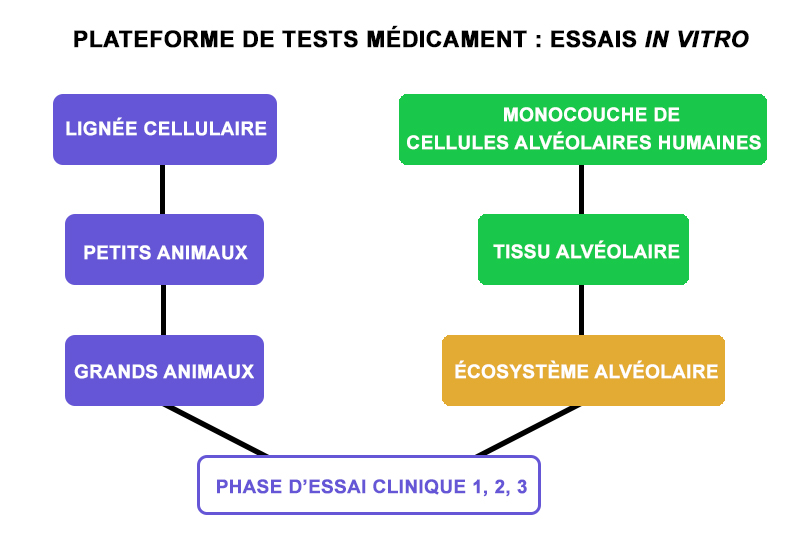
Outre le délai de production de cellules raccourci par une automatisation du procédé, l’approche du lab on a chip permet un gain de temps important du circuit de test du traitement. Les essais du médicament sont directement testés sur un écosystème de cellules humaines non embryonnaires, ce qui évite de passer par des essais animaliers, car comme l’explique Yong Chen, outre les questions d'éthiques, « la réponse aux drogues d'un animal peut être très différente de celle d’un homme en fonction de variables multiples comme la taille, le poids, la croissance, la résistance au virus… Des modèles in-vitro de cellules, tissus ou organes humaines, sont préférables avant des essais cliniques, d'où l'importance des iPSCs humaines. ».
Cette méthode a ainsi permis d’arriver à l’étape de test préalable aux phases d’essais cliniques (en jaune sur le schéma ci-dessous) en quelques mois seulement.
Soucieux de rendre leurs technologies stables et viables, Yong Chen et son équipe ont formalisé leur projet sous forme d’une startup. Ils se sont aussi concentrés sur la standardisation de leurs dispositifs et de l’automatisation de leurs protocoles, non sans certaines difficultés. « Un travail qui nécessite un soutien durable tant au niveau du personnel que du matériel comme la réparation ou le renouvellement de certains équipements, puisque nous devons assurer une continuité en technologie de fabrication de dispositifs et de différentiation de cellules souches » selon Yong Chen.
Il explique ainsi qu’évoluant au sein du département de chimie et non dans un environnement de biologie, « cela peut rendre parfois un peu complexe l’accès à certains outils et matériels spécifiques, comme des échantillons ex-vivo ». Mais le chercheur tempère volontiers : « L'environnement de l'ENS est extrêmement favorable au développement interdisciplinaire et transdisciplinaire, ce qui est nécessaire pour nos démarches à la fois scientifique et technologique, et qui mobilisent des compétences dans des domaines aussi variés que la biologie, la physique, chimie et l’ingénierie. »
(1) Les cellules souches pluripotentes induites par l’homme (iPSCs) ont le potentiel de se différencier en n'importe quelle cellule du corps humain et ont donc des applications très variées en thérapie et en recherche biomédicale. Elles sont considérées comme l'une des avancées majeures de la biotechnologie puisqu'elles permettent de constituer une alternative à l'utilisation de cellules souches embryonnaires humaines, permettant notamment de dépasser les problèmes éthiques liés à ces dernières. En savoir plus sur le site de l’Inserm
(2) Les cellules endothéliales composent la couche la plus interne des vaisseaux sanguins, en contact avec le sang.
|
Yong Chen est directeur de recherche au CNRS et directeur du laboratoire microfluidique à l’ENS-PSL. |
